Seminář - Coulometrie/Elektrogravimetrie
_________________________________ Coulometrie za konstantního proudu a potenciálu, standardní přídavek _________________________________
Příklad 43
Navážka jednosytné organické kyseliny o hmotnosti 151,6 mg byla rozpuštěna ve
vodě a coulometricky neutralizována hydroxidovým iontem produkovaným po dobu 6
min 22 s konstantním proudem 0,340 A.
F = 96 485 C mol-1
rovnice elektrodového děje: H2O + e- =
1/2 H2 + OH-
a) Vypočítejte látkové množství vygenerovaných iontů OH-.
b) Vyčítejte molekulovou hmotnost kyseliny.
Příklad 44
Obsah mědi ve vzorku byl stanoven coulometricky za konstantního proudu. Vzorek o hmotnosti 10 g byl rozpuštěn v H2SO4, převeden do odměrné baňky o objemu 250 ml a doplněn destilovanou vodou po rysku. Do coulometrické cely byl přidán základní elektrolyt a dále bylo pipetováno 5 ml připraveného vzorku, který obsahoval stanovenou měď ve formě CuSO4. Analýza, během které se na katodě vyloučila měď, proběhla při proudu 10 mA po dobu 1 hod 30 min.
F = 96 485 C mol-1,
M(Cu) = 63,546 g mol-1
a) Napište rovnici
elektrochemického děje na katodě.
b) Vypočítejte hmotnost mědi, která se vyloučí na katodě během analýzy 5 ml vzorku.
c) Vypočítejte hmotnostní zlomek mědi v původním vzorku.
Příklad 45
Roztok s neznámým obsahem kyseliny pikrové (v roztoku HCl o c = 1 mol l-1) byl elektrolyzován za konstantního potenciálu -0,65 V. Elektrolýza probíhala se 100% proudovým výtěžkem, přičemž kyselina pikrová se redukovala na triaminofenol dle rovnice:
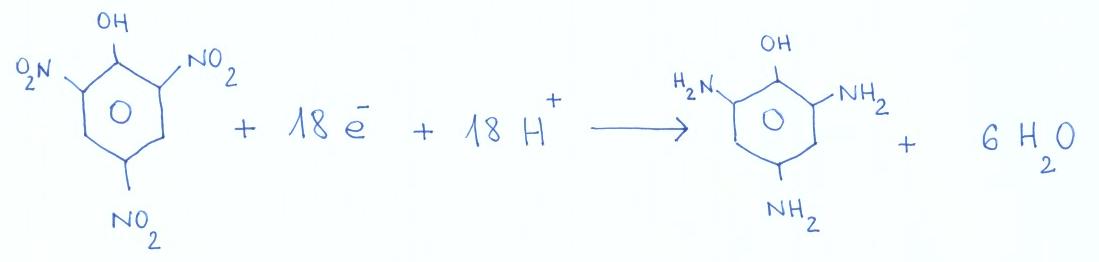
Za 100 s po zahájení elektrolýzy procházel elektrolyzérem proud 222 mA, za 600 s proud 32 mA. Kolik miligramů pikrové kyseliny (M = 229,1 g mol-1) bylo původně ve vzorku?
Příklad 46
Roztok pro polarografickou analýzu byl připraven smícháním 0,20 ml kapalného vzorku obsahujícího zinek s 5,0 ml základního elektrolytu. Z polarogramu byla zjištěna výška vlny zinečnatých iontů 48 mm. Do roztoku pak bylo přidáno ještě 0,10 ml standardního roztoku ZnSO4 o koncentraci 0,010 mol l-1 a po promíchání se vlna zvýšila na 68 mm. Vypočtěte koncentraci Zn2+ v původním kapalném vzorku.
Příklad 47
Hořčík v pitné vodě byl stanoven plamenovou absorpční spektrometrií metodou standardního přídavku. Do dvou odměrných baněk o objemu 100 ml bylo pipetováno 5 ml vzorku. První baňka byla doplněna destilovanou vodou po značku a promíchána. Do druhé baňky byly navíc přidány 2 ml standardního roztoku Mg2+ o hmotnostní koncentraci 0,05 g l-1. Pak byla i druhá baňka doplněna destilovanou vodou po rysku a promíchána. Měřením byly zjištěny následující hodnoty transmitance t1 = 0,613 (1.baňka) a t2 = 0,545 (2.baňka). Vypočtěte kolik mg hořčíku obsahuje 1 litr vzorku vody. M(Mg) = 24,305 g mol-1