Úvod
Vodík objevil roku 1766 Angličan Henry Cavendish[1,2,7]. V dněšní době je velmi důležitým chemickým prvkem. V řadě oborů, jako je například energetika, která se výrobou a využitím vodíku zabývá. Jeho popularita je způsobena právě energetickým průmyslem, který si od tohoto prvku slibuje, že se ho bude používat jako efektivní a dnes době jako ekonomický a ekologický zdroj energie. Vodík jako pohonná hmota se již používá v raketové technice, v palivových článcích, které vyrábějí proud, a zkoušejí se i možnosti pohonu motorových vozidel či letadel vodíkem samotným nebo společně s fosilními palivy.
Fyzikálně-chemické vlastnosti
Vodík je za normálních podmínek (tj. za teploty 273,15 K a tlaku 101325 Pa) hořlavý plyn, bez barvy, chuti a zápachu. Je asi 14,5× lehčí než vzduch (0,0899 kg m–3) a díky své nízké molekulové hmotnosti těžko stlačitelný. Se vzduchem vytváří výbušnou směs[3].
Ve sloučeninách je vodík schopen tvořit zvláštní typ chemické vazby, nazývaný vodíková vazba nebo-li vodíkový můstek, kdy vázaný atom vodíku vykazuje afinitu i k dalším atomům, s nimiž není poután klasickou chemickou vazbou. Mimořádně silná je vodíková vazba s atomy kyslíku, což vysvětluje anomální fyzikální vlastnosti vody (vysoký bod varu a tání atd.)[3,7].
Přehled fyzikálně-chemických vlastností | |
| Krystalová struktura | šesterečná (viz Obrázek 1) |
| Teplota tání | 14,025 K |
| Teplota varu | 20,268 K |
| Molární objem | 11,42 · 10−6m3 (½ mol H2 při 2 K) |
| Tlaknasycené páry | 209 Pa při 23 K |
| Rychlost zvuku | 1270 m/s při 298,15 K |
| Měrná tepelná kapacita | 14304 J/(kg K) |
| Tepelná vodivost | 0,1815 W/(m K) |
| Spalné teplo vodíku | 72 kJ/mol |
| Výhřevnost | 59,775 kJ/mol |
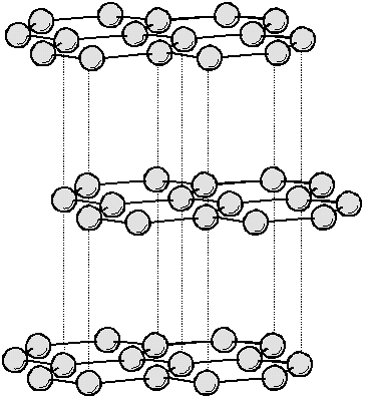
Obrázek 1: Krystalová struktura vodíku.
Chemické vlastnosti
Elementární vodík je na Zemi přítomen jen vzácně. Vodík má jeden vazebný elektron s elektronovou konfigurací 1s1, který s jiným atomem vodíku vytváří molekulu H2.
Je velmi reaktivní, vytváří sloučeniny se všemi prvky periodické tabulky s výjimkou vzácných plynů. Čistý vodík hoří za vzniku vodní páry nesvítivým až mírně namodralým plamenem[1,2,5].
- elektrolýza vody; na katodě se vylučuje vodík:
2 H+ + 2 e– H2,
H2, - reakce kovů I. A a II. A skupiny s vodou:
2 Na + 2 H2O 2 NaOH + H2,
2 NaOH + H2, - reakcí méně ušlechtilých kovů s vodnými roztoky kyselin a hydroxidů:
Zn + 2 HCl ZnCl2 + H2,
ZnCl2 + H2,
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
Výskyt
Vodík je základním stavebním prvkem celého vesmíru. V přírodě se elementární vodík (H) vyskytuje jen ojediněle, a to v okolí sopek. Plynný vodík (H2) je však v přírodě častější. Například jako součást zemního plynu a vůbec je obsažen ve všech organických sloučeninách. Je také spolu s uhlíkem, kyslíkem, dusíkem významným biogenním prvkem.
Vodík je základním stavebním prvkem celého vesmíru, vyskytuje se jak ve všech svítících hvězdách, tak v mezigalaktickém prostoru. Podle současných měření se podílí ze 75 % na hmotě a dokonce z 90 % na počtu atomů přítomných ve vesmíru.
Výroba
Vodík je možno vyrábět nebo získávat následujícími postupy:
- Štěpení uhlovodíků vodní párou
- Konverze vodního plynu
- Vodík z reformování benzinů
- Koksárenský plyn - zdroj vodíku
- Elektrolýza vody, kyselin, chloridu sodného
- Rozklad amoniaku
- Rozklad vody
a další…
Dále jsou uvedeny některé stručné popisy a výpočty nákladů na výrobu jednoho kubického metru vodíku (přepočteno na normální podmínky).
Podle stavové rovnice ideálního plynu pV = nRT, jeden metr kubický představuje za normálních podmínek toto látkové množství
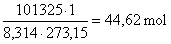 .
.
Redukcí zinkem
V přírodě se vyskytuje jako oxid zinečnatý. Zinek z něj vyredukovaný je schopen redukovat vodík podle následujících reakcí[1,4,11]:
 Zn + CO
Zn + CO
Zn + H2O
 ZnO + H2
ZnO + H2
Vzniklý oxid zinečnatý lze opět vrátit do reakce. Tato reakce probíhá při 350 °C, což není těžko dosažitelná teplota, aby tato reakce mohla probíhat přímo v automobilu. [1]
Cena zinku je v současné době $3,3 za kilogram (tj. 58,57 Kč)[6]
Průměrná cena "průmyslového" uhlí je 698,50 Kč/t[10].
Pokud jsme vyrobili 44,62 mol H2, tak je třeba to samé látkové množství C na redukci ZnO.
M(ZnO) = 81,38 g/mol, M(C) = 12 g/mol.
12 × 44,62 = 535,4 g C
212,7 Kč
0,37 Kč
Náklady na 1 m3 je tedy 213 Kč + množství energie, které je třeba na vytvoření reakčních podmínek obou reakcí.
Elektrolýzou
Nejvíce známou cestou výroby plynného vodíku je elektrolýza vody. Jedná se o rozklad na vodík a kyslík působením elektrického proudu. Takže jediná otázka je zde, kde brát dostatečně levnou elektřinu. Potřebná elektřina by mohla pocházet ze zdokonalených slunečních kolektorů nebo z vodních elektráren, případě i z jaderných reaktorů. Tepelným elektrárnám budoucnost neprorokuje, neboť produkují oxid uhličitý, oxid siřičitý a další nežádoucí toxické zplodiny. Tato výroba spočívá v elektrolýze vody podle následující reakce.
 H+ + OH–
H+ + OH– H2
H2 ½ H2O + ¼ O2 + e–
½ H2O + ¼ O2 + e– ½ H2 + ¼ O2
½ H2 + ¼ O2Vzniklý kyslík lze použít přireakci spalování vodíku. Elektrody na tento způsob výroby se požívají platinové, palladiové, rhodiové nebo niklové. Výhodou je, že vodík vyrobený touto metodou je ve vysoké čistotě.
Přivedená energie se musí rovnat nejméně hodnotě vazebné energie, což je přibližně 4,4 kWh/1 m3 vodíku[1, 2].
Cena za tuto energii závisí na smluvním tarifu s danou elektrárenskou společností. Například pro domácnosti, které by si sami chtěli vodík vyrábět, je pro tento rok cena 1320,34 Kč/1 MWh.
destilovaná voda: 0,8 l (× 1/efektivnost; efektivnost = 80 %) = 1 l, tj. 0,04967 × 0,1 = 0,4967 Kč
Štěpení uhlovodíků vodní párou
Tomuto způsobu se jinak říká parní reforming. Je to dnes nejlevnější a nejrozšířenější cesta, jak výrobit vodík. Teplo pro reakci i následnou konverzi CO je dodáváno z přímého spalování části zemního plynu.
Parní reforming může probíhat při teplotách 1200 - 1400 °C nebo v přítomnosti katalyzátorů Ni + MgO při teplotách 700 - 900 °C. Katalytický rozklad vyžaduje odsířenou surovinu, jelikož síra je pro katalyzátor jedem. Směs metanu a páry reaguje za vzniku vodíku a oxidu uhelnatého a menšího podílu oxidu uhličitého. Reakce probíhá za výše zmíněných teplot a tlaků v reforméru. Poté následuje navyšování množství produkovaného vodíku konverzí CO z reforméru s další přidanou párou. Reakce probíhá již za nižších teplot.
 CO + 3 H2
CO + 3 H2 CO + 3 H2
CO + 3 H2 CO2 + 4 H2
CO2 + 4 H2 CO2 + H2
CO2 + H2 CO + H2O
CO + H2OVýtěžnost vodíku je závislá na poměru páry a uhlíku ve směsi, ta se pohybuje okolo 80 %. Značnou nevýhodou je produkce vysokého množství oxidu uhličitého - na 1 kg vodíku se vyprodukuje 7,05 kg CO2.
Methanol se štěpí vodní párou v přítomnosti katalyzátorů na bázi ZnO a Cr2O3 při teplotách 300 až 400 °C a tlaku 3 MPa.
H2O (g) + CH3OH CO2 + 3 H2
CO2 + 3 H2
Účinnost přeměny je až 90 %. Jedná se o velmi pružnou výrobu a její výkon lze měnit v rozmezí 20 - 100 %. Na výrobu 1 m3 vodíku se spotřebuje asi 0,5 kg methanolu.[5]
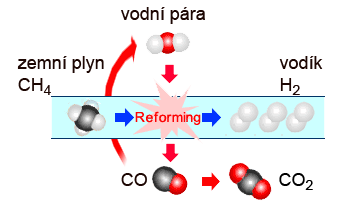
Obrázek 2: Proces parního reformingu.
Konverze vodního plynu
Vodní plyn nebo-li syntézní plyn je směs CO + H2. Při konverzi reaguje oxid uhelnatý s vodní párou za přítomnosti katalyzátorů (Fe2O3, Cr2O3 apod.) při teplotách 400 - 500 °C podle druhu katalyzátoru. Uvedené katalyzátory jsou citlivé na síru. Při konverzi probíhá reakce[1,5]:
 CO2 + H2
CO2 + H2
Vzniklý oxid uhličitý se odstraňuje vypíráním ve studené vodě, v alkalických roztocích (soda, potaš, apod.). Zbytky CO a CO2 se odstraňují hydrogenací na niklových katalyzátorech při teplotách 800 - 900 °C, kdy z obou oxidů vzniká metan. Malé množství CO lze také odstranit vypíráním amoniakálním roztokem mědných solí (mravenčan, uhličitan). Syntézní plyn se může také vyrábět zplyňováním uhlí, koksu nebo již zmíněným parním reformingem či parciální oxidací ropných frakcí.[1]
Z cekové rovnice je třeba na 3/10 mol (m3) metanu.
Uchovávání vodíku
Pro uchování v plynném stavu se používají zásobníky při tlaku 7 - 20 MPa, nebo zásobníky s vodíkem vázaným na hydridy nebo v podobě sloučenin (NH3, CH3OH, N2H4 apod.) V plynném stavu je vodík směsí 75 % orthovodíku (paralelní spiny) a 25 % paravodíku (antiparalelní spiny). Při zkapalňování se posunuje rovnováha k paravodíku a při teplotě varu je to až 100 %. Přechod na paravodík je pomalý, urychluje se katalyzátory (molekulová síta, hydroxidy železa apod.). Současně se uvolňuje teplo. Při varu přechází paravodík na orthovodík (endothermní pochod 694 kJ/kg).[9]
K uchovávání a transportu vodíku se v současné době používají ještě další typy nádrží. Ty však dokáží pojmout jen asi 5 - 6 % hmotnostímu množství zásobníku, což je pro komerční využijí zcela nedostatečné. Existují zde další řešení, a to v podobě organických struktur zvaných fulurenů. Ty jsou složeny z několika desítek uhlíkových atomů. Za podmínek asi 60 K a 10 MPa by bylo možné kapacitu zásobníku zvýšit asi na 13,5 %[8].
Palivo budoucnosti?
S honbou za výrobou vodí přeci neco musí stát. Jednak tempem neustále zvyšující se poptávky po palivech (obecně zdroji energii, jednoho dne dojdou světové zásoby dosavadních paliv, paliv fosilních, a doprava bude v krizi. Vlastně nemluvím ani tak o tak daleké budoucnosti. Zásoby vodíku jsou oproti těmto v podobě vody prakticky nevyčerpatelné. Avšak jediným oříškem je zde jeho ekologická výroba a bezpečné skladování. A jednak ekologická vyhlídka s "nulovými" emisemi, kdy spalovnáním vodíku vzniká čistá voda.
Jsou zde zatím dvě nejdiskutovanější varianty, jak vodík používat. Jedna je ta, že se bude přímo spalovat v motorech, a tak fungovat podobně jako benzinové motory, které známe dnes. Pak se tu ještě nabízí (zatím jako efektivnější varianta) vodíkové palivové články. Palivový článek je zařízení na výrobu elektrické energie na principu elektrochemické reakce.
V současnosti je největší naděje v palivovém článku na vodík. Skladování vodíku v automobilových nádržích je zatím problematické (výbušnost). Navíc účinnost celého cyklu (elektřina > vodík > elektřina) dosahuje jen asi 30-40 % (benzínové motory – 18 %)[7].
Závěrem
Představa používání ekologického vodíku je více než lákavá. Avšak je zde ta překážka jeho výroby a uchování. Čas ukáže, jak je lidsto schopno tuto představu uskutečnit, či je zde mechanismus přírody, která mu to nedovolí. Pak bychom se měli zamyslet, zda konáme dobře - zda jdeme tou správnou cestou. Doposud jsme získávali energii destruktivním způsobem - spalovním, z výbuchů. Ale, myslím si, že je tu i jiná cesta. Právě úplně opačným směrem...
Zdroje
- H2WEB [online]. Luboš Kotek, . [cit. 12-12-07]. Available from www: <http://vodik.czweb.org/>. 1801-5506.
- JAŠČUROVÁ, J. Vývoj pohonu automobilů na bázi vodíku. Žilina : Žilinská universita, 2005. 39 p.
- GREENWOOD, N.N. Chemie prvků. 1st ed. 1993.
- HORÁK, Z. Zelená budoucnost pro auta - Vodík [online]. Zbyněk Horák, 2007. , 27.10.2007 [cit. 15-11-07]. Available from www: <http://oze.ic.cz>.
- Česká vodíková technologická platforma [online]. MPOČR, 2006. , 11/2007 [cit. 5-12-07]. Available from www: <http://www.hytep.cz/>.
- ČERMÁK, P. Zinek pod prodejním tlakem [online]. Colosseum, 4.12.2007. [cit. 5-12-07]. Available from www: <http://www.finance.cz/zpravy/finance/140308-zinek-pod-prodejnim-tlakem/>.
- Wikipedia [online]. Wikimedia Foundation, 2001, last modified 05:32, 19 March 2007 [cit. 2007-03-19]. Available from www: <'http://en.wikipedia.org/wiki/Wikipedia'>.
- Fullerenes Store Hydrogen [online]. AlphaGalileo Foundation, 20.03.2007. Available from www: <http://www.alphagalileo.org/.
- FORSBERG, C.W. Future hydrogen markets for large-scale hydrogen production systems. Int. J. Hydrogen energy [online]. 2007, 32.
- Ceny zemního plynu [online]. Topinfo, . [cit. 10-12-07]. Available from www: <http://www.tzb-info.cz/t.py?t=4&i=13&h=3>.
- Ceník produktů Skupiny ČEZ pro domácnosti [online]. ČEZ, . [cit. 10-12-07]. Available from www: <http://www.cez.cz/presentation/cze/GetFile?type=FilFile&version=-2&id=86622>.
- HYRÁK, Z. Zelená budoucnost pro auta - Vodík [online]. 1. , 27.10.2007 [cit. 16-12-01]. Available from www: <http://oze.ic.cz/zelena-budoucnost-pro-auta-vodik/index.php>.